Какую фигуру представляет собой химическая формула бензола. Строение молекулы бензола
ОПРЕДЕЛЕНИЕ
Ароматические углеводороды (арены) - вещества, в молекулах которых содержится одно или несколько бензольных колец.
Общая формула гомологического ряда бензола C n H 2 n -6 . Простейшими представителями ароматических углеводородов являются бензол - C 6 H 6 и толуол - C 6 H 5 -CH 3 . Углеводородные радикалы, полученные из аренов носят названия: C 6 H 5 - — фенил (Ph-) и C 6 H 5 -CH 2 — — бензил.
Первые члены гомологического ряда бензола - бесцветные жидкости со специфическим запахом. Они легче водды и в ней практически нерастворимы. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями.
Электронное строение бензолов
Рассмотрим строение ароматических углеводородов на примере молекулы бензола. Это химическое соединение впервые было выделено из продуктов переработки каменного угля в 1825 году, однако, для того, чтобы установить строение его молекулы потребовалось три десятилетия. В 1865 году немец Ф. А. Кекуле высказал идею о том, что атомы углерода в бензоле соединены не в виде открытой цепи, а замкнуты в цикл (рис. 1). По его представлениям молекула бензола - это замкнутый цикл, состоящий из шести атомов углерода с тремя чередующимися двойными связями. Однако Кекуле так и не смог объяснить ряд особых свойств, присущих бензолу: почему бензол не проявляет склонность к реакциям присоединения (не обесцвечивает бромную воду и перманганат калия) несмотря на наличие двойных связей и т.д.
Рис. 1. Строение молекулы бензола по Кекуле.
Согласно представлениям современной органической химии, молекула бензола является правильным плоским шестиугольником. Все шесть атомов углерода находятся в sp 2 -гибридном состоянии. Каждый атом углерода образует σ - связи с двумя атомами углерода и одним атомом водорода, лежащими в плоскости цикла. Валентные углы между тремя σ - связями равны 120 o .
Каждый атом углерода в молекуле бензола имеет одну негибридизованнуюp - орбиталь. Шесть этих орбиталей располагаются перпендикулярно плоскому σ - скелету и параллельно друг другу. При их взаимном перекрывании образуется единое π-электронное облако, т.е. осуществляется круговая делокализация электронов. Наибольшая π-электронная плотность в этой сопряженной системе располагается над плоскостью σ - скелета молекулы и охватывает все шесть атомов углеродного цикла. В результате все связи между атомами углерода в бензоле выравнены и имеют длину 0,139 нм (рис. 2).

Рис. 2. Строение молекулы бензола.
Совокупность свойств бензола называют проявлением ароматического характера, или ароматичности. Явление ароматичности подчиняется правилу Хюккеля, согласно которому ароматические молекулы должны иметь плоский циклический σ - скелет и число обобщенных π-электронов, равное (4n+2), где n = 0, 1, 2, 3 и т.д.
Примеры решения задач
ПРИМЕР 1
| Задание | Плотность паров вещества 3,482 г/л. Его пиролиз дал 6 г сажи и 5,6 л водорода. Определите формулу этого вещества. |
| Решение | Сажа представляет собой углерод. Найдем количество вещества сажи исходя из условий задачи (молярная масса углерода равна 12 г/моль):
n(C) = m(C) / M(C); n(C) = 6 / 12 = 0,5 моль. Рассчитаем количество вещества водорода: n(H 2) = V(H 2) / V m ; n(H 2) = 5,6 / 22,4 = 0,25 моль. Значит, количество вещества одного атома водорода будет равно: n(H) = 2 × 0,25 = 0,5 моль. Обозначим количество атомов углерода в молекуле углеводорода за «х», а количество атомов водорода за «у», тогда соотношение этих атомов в молекуле: х: у = 0,5: 0,5 =1:1. Тогда простейшая формула углеводорода будет выражаться составом СН. Молекулярная масса молекулы состава СН равна: М(СН) = 13 г/моль Найдем молекулярную массу углеводорода исходя из условий задачи: M (C x H y) = ρ×V m ; M (C x H y) = 3,482×22,4 = 78 г/моль. Определим истинную формулу углеводорода: k= M(C x H y)/ М(СН)= 78/13 =6, следовательно, коэффициенты «х» и «у» нужно умножить на 6 и тогда формула углеводорода примет вид C 6 H 6 . Это бензол. |
| Ответ | Искомый углеводород имеет состав C 6 H 6 . Это бензол. |
Ароматические углеводороды (арены)
Представители ароматических углеводородов - бензол С 6 Н 6 и его гомологи -имеют циклическое строение. Οʜᴎ могут иметь насыщенные или ненасыщенные боковые цепи. Некоторые из производных бензола обладают приятным запахом. По этой причине сохранилось их прежнее историческое название - ароматические углеводороды. Сегодня известны многие вещества, которые по строению и химическим свойствам следует отнести к ароматическим углеводородам. Бензол является самым типичным представителем ароматических углеводородов, в молекуле которого шесть атомов углерода.
Экспериментальные данные показывают, что в молекуле бензола 92,3 % углерода, как и в молекуле ацетилена. Следовательно, простейшая формула бензола должна быть такая же, как у ацетилена, - СН. Но плотность паров бензола по водороду равна 39, а масса его моля - 78 г (2D H = 2‣‣‣39). В случае если формула бензола действительно была бы СН, то масса его моля должна быть 13 г, а не 78 ᴦ. Следовательно, молекула бензола состоит из шести атомов углерода и шести атомов водорода (78: 13 = 6), а его молекулярная формула С 6 Н б.
Эксперименты показали, что при повышенной температуре и в присутствии катализаторов к каждой молекуле бензола присоединяются три молекулы водорода и образуется циклогексан. Этим доказывается, что бензол имеет циклическое строение. При этом эксперименты показали, что все связи в молекуле бензола равноценны.
Согласно современным представлениям, в молекуле бензола у каждого атома углерода одно s- и два р-электронных облака гибридизованы (sp 2 -гибридизация), а одно р-электронное облако негибридизованное. Все три гибридизованных электронных облака, перекрываясь с гибридизованными облаками соседних атомов углерода и s-облаками атомов водорода, образуют три σ-связи, которые находятся в одной плоскости. Негибридизованные р-электронные облака атомов углерода расположены перпендикулярно плоскости направления σ -связей. Эти облака тоже перекрываются друг с другом (рис. 40).
 |
В цикле молекулы бензола нет трех отдельных двойных связей: негибридизованное р-электронное облако первого атома углерода перекрывается с негибридизованными р-электронными облаками второго и шестого атомов углерода, а р-электронное облако второго атома углерода перекрывается с негибридизованными р-электронными облаками первого и третьего атомов углерода
Так как электронная плотность в молекуле бензола распределена равномерно, то правильнее структурную формулу бензола изображать в виде шестиугольника с окружностью внутри. Известно много сходных с бензолом ароматических углеводородов - гомологов бензола. Соединения углерода и водорода, в молекулах которых имеется бензольное кольцо, или ядро, относятся кароматическим углеводородам. Сегодня используют формулу I (Фридриха Кекуле (1829-1896) 1865 ᴦ.) или III. Радикал –С 6 Н 5 принято называть фенилом.
Ароматические углеводороды – соединения углерода и водорода, в молекуле которых имеется бензольное кольцо. Важнейшими представителями ароматических углеводородов являются бензол и его гомологи – продукты замещения одного или более атомов водорода в молекуле бензола на углеводородные остатки.
Строение молекулы бензола
Первое ароматическое соединение – бензол – было открыто в 1825 г. М. Фарадеем. Была установлена его молекулярная формула – С 6 Н 6. Если сравнить его состав с составом предельного углеводорода, содержащего такое же количество атомов углерода, — гексаном (С 6 Н 14), то можно заметить, что бензол содержит на восемь атомов водорода меньше. Как известно, к уменьшению количества атомов водорода в молекуле углеводорода приводит появление кратных связей и циклов. В 1865 г. Ф. Кекуле предложил его структурную формулу как циклогексантриена – 1, 3, 5.

Таким образом, молекула, соответствующая формуле Кекуле
, содержит двойные связи, следовательно, бензол должен иметь ненасыщенный характер, т. е. легко вступать в реакции присоединения: гидрирования, бромирования, гидратации и т. д.
Однако данные многочисленных экспериментов показали, что бензол вступает в реакции присоединения только в жестких условиях (при высоких температурах и освещении), устойчив к окислению. Наиболее характерными для него являются реакции замещения, следовательно, бензол по характеру ближе к придельным углеводородам.
Пытаясь объяснить эти несоответствия, многие ученые предлагали различные варианты структуры бензол. Окончательно строение молекулы бензола было подтверждено реакцией его образования из ацетилена. В действительности углерод — углеродные связи в бензоле равноценны, и их свойства не похожи на свойства ни одинарных, ни двойных связей.
В настоящее время бензол обозначают или формулой Кекуле, или шестиугольником, в котором изображают окружность.
![]()
Так в чем же особенность структуры бензола? На основании данных исследователей и расчетов сделан вывод о том, что все шесть углеродных атомов находятся в состоянии sp 2 -гибридизации и лежат в одной плоскости. Негибридизированные p -орбитали атомов углерода, составляющие двойные связи (формула Кекуле), перпендикулярны плоскости кольца и параллельны друг другу.
Они перекрываются между собой, образуя единую π-систему. Таким образом, система чередующихся двойных связей, изображенных в формуле Кекуле, является циклической системой сопряженных, перекрывающихся между собой -связей. Эта система представляет собой две тороидальные (похожие на бублик) области электронной плотности, лежащие по обе стороны бензольного кольца. Так, изображать бензол в виде правильного шестиугольника с окружностью в центре (π -система) более логично, чем в виде циклогексатриена-1,3,5.
Американский ученый Л. Полинг предложил представлять бензол в виде двух граничных структур, отличающихся распределением электронной плотности и постоянно переходящих друг в друга, т. е. считать его промежуточным соединением, «усреднением» двух структур.
Данные измерения длин связей подтверждают эти предположения. Выяснено, что все С-С связи в бензоле имеют одинаковую длину (0,139 нм). Они несколько короче одинарных С-С связей (0,154 нм) и длиннее двойных (0,132 нм).
Существуют также соединения, молекулы которых содержат несколько циклических структур.

Изомерия и номенклатура
Для гомологов бензола характерна изомерия положения нескольких заместителей . Простейший гомолог бензола - толуол (метилбензол) — не имеет таких изомеров; следующий гомолог представлен в виде четырех изомеров:

Основой названия ароматического углеводорода с небольшими заместителями является слово бензол
. Атомы в ароматическом кольце нумеруют, начиная от старшего заместителя к младшему:

По старой номенклатуре положения 2 и 6 называют ортоположениями
, 4 - пара-
, а 3 и 5 - метаположениями.
Физические свойства
Бензол и его простейшие гомологи в обычных условиях весьма токсичные жидкости с характерным неприятным запахом. Они плохо растворяются в воде, но хорошо - в органических растворителях.
Химические свойства бензола
Реакции замещения
. Ароматические углеводороды вступают в реакции замещения.
1. Бромирование.
При реакции с бромом в присутствии катализатора, бромида железа (ΙΙΙ), один из атомов водорода в бензольном кольце может замещаться на атом брома:

2. Нитрирование бензола и его гомологов . При взаимодействии ароматического углеводорода с азотной кислотой в присутствии серной (смесь серной и азотной кислот называют нитрующей смесью) происходит замещение атома водорода на нитрогруппу -NO 2:

Восстановлением образовавшегося в этой реакции нитробензола получают анилин — вещество, которое применяется для получения анилиновых красителей:

Эта реакция носит имя русского химика Зинина.
Реакции присоединения.
Ароматические соединения могут вступать и в реакции присоединения к бензольному кольцу. При этом образуются циклогексан или его производные.
1. Гидрирование
. Каталитическое гидрирование бензола протекает при более высокой температуре, чем гидрирование алкенов:
![]()
2. Хлорирование. Реакция идет при освещении ультрафиолетовым светом и является свободнорадикальной:

Гомологи бензола
Состав их молекул отвечает формуле С n H 2 n-6 . Ближайшие гомологи бензола:
Все следующие за толуолом гомологи бензола имеют изомеры. Изомерия может быть связана как с числом и строением заместителя (1, 2), так и с положением заместителя в бензольном кольце (2, 3, 4). Соединения общей формулы С 8 Н 10:

По старой номенклатуре, употребляемой для указания относительного расположения двух одинаковых или разных заместителей в бензольном кольце, используют приставки орто
— (сокращенно о-) – заместители расположены у соседних атомов углерода, мета-
(м
-) – через один атом углерода и пара
— (п
-) – заместители друг против друга.
Первые члены гомологического ряда бензола – жидкости со специфическим запахом. Они легче воды. Являются хорошими растворителями.
Гомологи бензола вступают в реакции замещения (бромирование, нитрирование). Толуол окисляется перманганатом при нагревании:

Гомологи бензола используются как растворители, для получения красителей, средств для защиты растений, пластмасс, лекарств.



















АРЕНЫ
Арены - это углеводороды с общей формулой С n H 2 n - 6 в молекулах которых есть одно или несколько бензольных колец.
СТРОЕНИЕ БЕНЗОЛА
Главным представителем аренов является бензол - С 6 Н 6 . По составу это соединение непредельное, до полного насыщения всех связей атомов углерода не хватает 8 атомов водорода. В 1911 г бензол был получен из циклогексана (реакция Зелинского), что явилось доводом в пользу гипотезы о циклическом строении бензола. Позже была осуществлена обратная реакция - гидрирование бензола (реакция Сабатье). В 1865 г немецкий химик А.Кекуле предложил структурную формулу бензола:
Согласно формуле Кекуле бензол имеет 3 двойные связи и, следовательно, должен вступать в реакции присоединения. Однако, бензол не дает типичных для непредельных соединений реакций (не обесцвечивает бромную воду и раствор перманганата калия). Этот факт находится в противоречии с формулой Кекуле. Кроме того , эта формула не объясняет высокой устойчивости бензольного кольца.
Согласно современным представлениям молекула бензола имеет строение плоского шестиугольника с равными сторонами. Атомы углерода в бензоле находятся в состоянии sp 2 - гибридизации. При этом гибридные орбитали образуют обычные  - связи, а негибридная - перекрывается с двумя другими негибридными орбиталями соседних углеродных атомов. В результате образуется единое облако делокализованных
- связи, а негибридная - перекрывается с двумя другими негибридными орбиталями соседних углеродных атомов. В результате образуется единое облако делокализованных  - электронов (рис 5). В результате такого равномерного перекрывания 2р - орбиталей всех шести углеродных атомов происходит "выравнивание" простых и двойных связей, то есть в молекуле бензола отсутствуют классические двойные и одинарные связи. Для того чтобы подчеркнуть выравненность - электронной плотности в молекуле бензола предложена следующая структурная формула:
- электронов (рис 5). В результате такого равномерного перекрывания 2р - орбиталей всех шести углеродных атомов происходит "выравнивание" простых и двойных связей, то есть в молекуле бензола отсутствуют классические двойные и одинарные связи. Для того чтобы подчеркнуть выравненность - электронной плотности в молекуле бензола предложена следующая структурная формула:
Арены имеют и тривиальное название "ароматические углеводороды". Понятие "ароматичности" не связано с запахом углеводородов, хотя многие из них обладают им. Под "ароматичностью" понимают некоторые особенности строения углеводородов, главной из которых является равномерное распределение - электронной плотности в молекуле. Кроме того, ароматические соединения подчиняются правилу Э.Хюккеля: плоские моноциклические соединения , имеющие сопряженную систему - электронов, могут быть ароматическими, если число этих электронов равно 4п+2 (где п=0,1,2 и т.д.).
ИЗОМЕРИЯ И НОМЕНКЛАТУРА АРЕНОВ
По систематической номенклатуре арены рассматривают как производные бензола. Названия образуются от названий радикалов боковых цепей с добавлением окончания бензол.
СН 3 С 2 Н 5
метилбензол этилбензол
В случае если в бензольном кольце имеется два заместителя, то они могут отличаться своим взаимным расположением в кольце. Так, при замещении двух водородных атомов на метильные радикалы могут образоваться три изомера (орто-, мета- и пара-).
СН 3 СН 3 СН 3


 СН 3
СН 3
Орто-ксилол мета-ксилол пара-ксилол
(1,2 - диметилбензол) (1,3-диметилбензол) (1,4 - диметилбензол)
Нумерацию бензольного кольца ведут таким образом, чтобы сумма цифр была наименьшей. Многие арены имеют тривиальные названия , которые применяются очень часто (метилбензол - толуол; диметилбензол - ксилол).
Изомерия в гомологическом ряду бензола может быть связана как числом и строением заместителей, так и с их положением в бензольном кольце.
СВОЙСТВА АРЕНОВ
1. Химические свойства бензола.
Несмотря на формальную непредельность для бензола более характерны реакции замещения. Это объясняется особенностями строения бензольного кольца. В присутствии катализаторов FeBr 3 , AlCl 3 может идти замещение атомов водорода в молекуле бензола на атомы галогенов. Эти реакции идут практически в обычных условиях.
C
6
H
6
+
Br
2
FeBr
3
C
6
H
5
Br
+
HBr
При взаимодействии с бензола азотной кислотой в присутствии концентрированной серной кислоты в качестве водоотнимающего средства идет образование нитробензола:
C
6
H
6
+
HNO
3
50
C
C
6
H
5
NO
2
+
H
2
O
В присутствии безводного хлорида алюминия в качестве катализатора может протекать реакция алкилирования
бензола (Реакция Фриделя - Крафтса).
В результате к бензольному кольцу присоединяется углеводородный радикал.
AlCl 3
Н + Cl CH 3 СН 3 + HCl
Реакции присоединения менее характерны для бензола, но они есть. Так, каталитическое гидрирование бензола идет в присутствии никелевых (150 о) или платиновых (50 о) катализаторов. Бензол при этом превращается в циклогексан.
3Н 2
При сильном освещении (УФ - облучение) в отсутствие кислорода бензол способен присоединять хлор, образуя производное циклогексана - гексахлорциклогексан (гексахлоран).
С 6 Н 6 + 3Н 2 hv C 6 H 6 Cl 6
В реакциях присоединения происходит разрушение ароматической системы.
2.Химические свойства гомологов бензола.
Гомологи бензола химически более активны чем сам бензол. Это объясняется влиянием углеводородного радикала на бензольное кольцо. Радикалы являются электродонорными заместителями, то есть они подают электроны в бензольное кольцо, нарушая равномерное распределение электронной плотности в кольце в орто - и пара - положениях. В этих положениях повышается электронная плотность и облегчается вхождение заместителей. Так, например , толуол (метилбензол) нитруется очень легко, даже без нагревания. При этом идет образования тринитротолуола.


3HNO 3 NO 2 NO 2 + 3H 2 O
Галогенирование гомологов бензола идет по-разному в зависимости от условий реакции. При освещении галоген замещает водород в радикале, а в присутствии катализатора - встраивается в бензольное кольцо:
CH 3 CH 2 Cl


Cl 2 hv + HCl


Cl 2 + HCl
Известно, что влияние атомов и групп атомов в молекулах органических веществ взаимно. Поэтому в молекулах гомологов бензола не только радикалы влияют на активность бензольного кольца, но и кольцо влияет на активность радикалов. В частности снижают устойчивость радикалов к окислению. Если, например, прилить раствор перманганата калия к толуолу и нагреть смесь , то фиолетовая окраска раствора постепенно исчезнет. Это происходит вследствие окисления метильной группы.
В реакции окисления толуола перманганатом калия метильная группа окисляется в карбоксильную - образуется бензойная кислота. Схема этой реакции выглядит следующим образом:

 СН 3 СООН
СН 3 СООН

Остальные продукты реакции будут зависеть от выбранного окислителя и среды в которой протекает реакция. Подобным образом окисляются и другие гомологи с одной боковой цепью. Гомологи, содержащие две боковые цепи, дают двухосновную фталевую кислоту.


СН 3 СООН
СН 3 СООН
Бензол и его гомологи горят на воздухе коптящим сильно пламенем, что связано с высоким процентным содержанием углерода.
2С 6 Н 6 + 15О 2 12СО 2 + 6Н 2 О
3. Физические свойства аренов.
Низшие члены гомологического ряда бензола - чаще всего жидкости, обладающие характерным запахом. Углеводороды , в состав которых входит не более одного бензольного кольца, как правило, легче воды. Арены в воде нерастворимы, но хорошо растворяются в органических растворителях, и сами являются таковыми. Физические свойства некоторых представителей аренов приведены ниже в таблице.
СПОСОБЫ ПОЛУЧЕНИЯ АРЕНОВ
В промышленности 90 % получаемого бензола выделяют при переработке каменноугольной смолы при ее фракционировании. Другим источником получения аренов является нефть, которые выделяют из нее простой перегонкой, пиролизом , а также каталитическим крекингом.
Ароматизация парафинов (каталитический риформинг):
СН 3 СН 3


Pt, 350 o C
метилциклогексан метилбензол
При дегидрировании циклогексана подобным образом образуется бензол.
Гомологи бензола могут быть получены по реакции Фриделя - Крафтса (см. раздел свойства бензола).
Реакция Вюрца - Фиттига . Эта реакция подобна реакции Вюрца в ряду алканов:



+ 2Na + Br C 2 H 5 + 2NaBr
Br C 2 H 5
Синтез из солей ароматических карбоновых кислот:
![]()
С 6 Н 5 СООNa + NaO H t C 6 H 6 + Na 2 CO 3
6. Синтез из ацетилена. Реакция Зелинского.
3 СН СН
АРЕНЫ В ПРИРОДЕ. ПРИМЕНЕНИЕ АРЕНОВ.
Изредка арены в свободном виде входят в состав нефтей. Кроме того, они образуют сложные структуры в составе углей. Арены очень широко применяются в различных отраслях промышленности. Бензол является сырьем для производства различных химических продуктов: нитробензола, анилина, хлорбензола, стирола. Толуол используется для производства красителей , лекарственных и взрывчатых веществ (тол, тротил), а также является исходным продуктом при получении синтетических моющих средств, капролактама. Является хорошим растворителем. Ксилолы используются для получения веществ являющихся исходным сырьем для производства синтетических волокон (лавсана).
МНОГОЯДЕРНЫЕ АРЕНЫ
Многоядерные ароматические соединения содержат несколько бензольных колец. В зависимости от характера строения различают соединения с конденсированными и неконденсированными бензольными ядрами. Простейшими и практически важными являются нафталин и антрацен.


НАФТАЛИН



- АНТРАЦЕН
Нафталин - бесцветное кристаллическое вещество, довольно летучее (температура плавления - 80 о С). Служит сырьем для синтеза фталевого ангидрида, фталевой кислоты и других продуктов. Применяется в быту для отпугивания моли и других насекомых. В химическом поведении имеет много общего с бензолом , но в реакции замещения вступает легче, чем сам бензол.
Антрацен - кристаллическое вещество с температурой плавления 213 о С. Получается из каменноугольной смолы. Большое значение имеют различные производные антрацена. К ним, например, относятся антрахинон, ализарин и т.д. Ализарин - самый распространенный из диоксиантрахиноновых красителей, применяется для крашения шерсти и хлопка. Впервые ализарин выделили из корня марены. Ализарин - протравный краситель. По алюминиевой протраве он красит в ярко - красный цвет , по хромовой - в коричневый, по железной - в фиолетовый.
ЗАДАНИЯ И УПРАЖНЕНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ ТЕМЫ
Какие углеводороды называются аренами?
Охарактеризуйте особенности строения молекулы бензола.
Назовите важнейшие способы получения аренов, приведите соответствующие уравнения реакций.
На примере бензола охарактеризуйте важнейшие химические свойства аренов. Объясните , почему для бензола более характерны реакции замещения. Объясните, почему в обычных условиях бензол устойчив к действию окислителей.
В чем отличия в химических свойствах гомологов бензола от свойств самого бензола. Объясните, чем обусловлены эти отличия.
Составьте формулы следующих веществ: бромбензол; 1,3 - диметилбензол; 1,3 - диметил 4 - хлорбензол; пропилбензол; 1,3 - динитробензол.
Составьте уравнения реакций взаимодействия:
Метилбензола с водородом;
Метилбензола с хлором (при освещении);
Этилбензола с азотной кислотой
Бензола с хлорэтаном (в присутствии хлорида алюминия)
Бензол, полученный дегидрированием циклогексана объемом 151 мл и плотностью 0,779 г/мл, подвергли хлорированию при освещении. Образовалось хлоропроизводное массой 300 г. Определите выход продукта реакции.
Какой объем воздуха (при н.у.) потребуется для сжигания 1,4 - диметилбензола массой 5,3 г? Объемная доля кислорода в воздухе составляет 21%.
85 г бензола прореагировало с концентрированной азотной кислотой массой 160 г. Какой продукт образовался, и какова его масса.
Какой объем водорода (н.у.) образуется при циклизации и дегидрировании н-гексана объемом 200 мл и плотностью 0,66 г/мл? Реакция протекает с выходом 65 %.
При окислении смеси бензола и толуола раствором перманганата калия при нагревании получено после подкисления 8,54 г одноосновной органической кислоты. При взаимодействии этой кислоты с избытком водного раствора гидрокарбоната натрия выделился газ, объем которого в 19 раз меньше объема такого же газа , полученного при полном сгорании исходной смеси углеводородов. Определите состав исходной смеси (в % по массе).
Газ, выделившийся при получении бромбензола из 22,17 мл бензола (плотность - 0,8 г/мл), ввели в реакцию с 4,48 л изобутена. Какие соединения образовались и какова их масса, если учесть, что выход бромбензола составил 80% от теоретического, а реакция с изобутеном идет с количественным выходом.
Смесь бензола, циклогексана и циклогексена при обработке бромной водой присоединяет 16 г брома; при каталитическом дегидрировании исходной смеси образуется 39 г бензола и водород, объем которого в два раза меньше объема водорода необходимого для полного гидрирования исходной смеси углеводородов. Определите состав исходной смеси.
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах , но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.

Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.

Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.

Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.

Третье свойство алкилирование бензола галогеналканами.

Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.

Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке гидрирование, присоединение водорода.
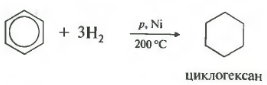
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.

Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.

Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.

Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.

В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.

Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.




