«Регенерация и репарация. Процессы адаптации и компенсации. Асептическое воспаление как один из механизмов восстановления функции тканей
ВВЕДЕНИЕ.
Целью данного реферата является сравнение двух процессов - процесса
злокачественного перерождения ткани и процесса репаративной регенерации. На
первый взгляд в них нет ничего общего, хотя наверняка это не так.
Мой реферат будет состоять из трех частей - в первой и второй частях я
опишу сущность процессов репарации и онкогенеза, влияющие на эти процессы
факторы, некоторые основные понятия связанные с этими явлениями. В
последней, третьей части я попытаюсь сравнить некоторые явления и процессы,
имеющие место быть в том или другом случае.
Начать следует с основных понятий:
«РЕГЕНЕРАЦИЯ (позднелатинское regeneratio –
возрождение, восстановление) – обновление структур организма в процессе
жизнедеятельности и восстановление структур, утраченных в результате
патологических процессов. Различают физиологическую и репаративную
регенерацию.
Физиологическая регенерация – непрерывное обновление структур на клеточном
(смена клеток крови, эпидермиса, печени и д.р.) и внутриклеточном
(обновление клеточных органелл) уровнях, благодаря чему обеспечивается
функционирование органов и тканей.
Репаративная регенерация – процесс ликвидации структурных повреждений после
действия патогенных факторов. В ее основе лежат такие же механизмы, как и
при физиологической регенерации, она отличается лишь большей интенсивностью
проявлений. Репаративную регенерацию, в процессе которой восстанавливается
ткань, идентичная погибшей, называется полной, или реституцией. В ряде
случаев в результате репаративной регенерации в зоне повреждения образуется
не специфическая для данного органа ткань, а рубец – неполная регенерация
или субституция. При некоторых состояниях организма (гиповитаминозе,
истощении и д.р.) течение репаративной регенерации бывает затяжным,
качественно извращенным (сопровождается образованием длительно незаживающих
язв, формирование ложного сустава и д.р.), то есть наблюдается
патологическая регенерация.
Процесс регенерации происходит на всех уровнях – органном, тканевом,
клеточном, внутриклеточном. Осуществляется он путем деления клеток,
обновления внутриклеточных структур и их размножения.
ОНКОГЕНЕЗ представляет собой длительный и многостадийный процесс,
состоящий из совокупности событий, которые в экспериментальных моделях
разделяют на стадии инициации, промоции и прогрессии. Хотя концепция
многостадийности онкогенеза была разработана исходя из результатов опытов с
использованием лабораторных животных, считается, что у человека опухолевый
процесс развивается подобным образом. Согласно существующим представлениям,
неопластическое перерождение ткани может происходить в результате
генетических изменений в одной клетке, которая в результате митотического
деления дает начало клону клеток, имеющих трансформированный фенотип. Эти
клетки претерпевают множественные изменения, прежде чем стать опухолевыми,
и каждая из стадий онкогенеза характеризуется определенными
фенотипическими, генотипическими и биохимическими особенностями.
РАКОВОЕ ПЕРЕРОЖДЕНИЕ.
ОНКОГЕНЫ, ПРОТООНКОГЕНЫ, АНТИОНКОГЕНЫ.
Во всех нормальных клетках есть гены, близкие по структуре к вирусным
онкогенам, они были названы протоонкогенами. Эти гены регулируют
нормальное поведение клетки – ее ответ на ростовые факторы, на гормоны,
нормальный темп и «расписание» делений. Протоонкогены находятся под
тщательным и жестким контролем других генов. Мутации протоонкогенов выводят
их из-под воздействия контролирующих генов, делают их автономными. Как
правило, воздействие различных канцерогенных факторов приводит к постоянной
активности протоонкогена. Так хромосомные транслокации ведут к тому, что
потоокоген попадает под контроль постоянно действующего в данной ткани
гена, и он работает непрерывно, не давая клетке выйти из цикла делений
(myc), или посылая непрерывные сигналы с мембраны в ядро(ras) , или приводя
к синтезу ростовых факторов, посылающих для той же клетки сигналы к делению
(аутокринная стимуляция). Канцерогенные вещества и облучение обладают
высокой мутагенной активностью, они вызывают изменения во многих генах, в
том числе и в протоонкогенах. Эти мутации могут вести либо к нарушению
регуляции протоонкогена, и тогда он выходит из-под контроля, либо к
изменению свойств белка, контролируемого этим геном. Мутировавшие онкогены
могут вызывать синтез онкобелка с измененными свойствами, и этот белок
вызывает уже те процессы, которые определяют характерное асоциальное
поведение клетки.
Итак, общим звеном в возникновении опухолей является онкоген,
внесенный в клетку вирусом, или возникший из протоонкогена, а результате
мутации, или выведенной из-под контроля сдерживающих генов хромосомной
транслокации. Но в последние годы найдено еще одно звено, по-видимому,
наиболее общее звЕно канцерогенеза – гены-супрессоры опухолей, подавляющие
активность онкогенов. Главный представитель антионкогенов - р53 ,
названный по продукту от р-protein, и 53 – тк вес 53000 дальтон.
Было показано, что накопление продуктов нормального гена р53
останавливает прохождение клеткой митотического цикла на границе G1 и S . в
результате поврежденная клетка не может удвоить поврежденную ДНК и передать
геном своим клеткам-потомкам при делении. У клетки есть спец ферменты,
ремонтирующие испорченную ДНК. Если через какое-то время повреждение
исправлено, то вызванный р53 блок деления снимается, и клетка может вновь
размножаться. Если повреждение ДНК не исправлено, тор53 включает программу
апоптоза.
БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
ОПУХОЛЕВЫХ КЛЕТОК.
Самой характерной биологической особенностью опухолевых клеток
является их автономность – независимость темпа размножения и других
проявлений их жизнедеятельности от внешних воздействий (по отношению к
клеткам), изменяющих и регулирующих жизнь нормальных клеток. Неправильно
опухоли - любое новообразование сохраняет ту или иную степень зависимости
от воздействующих на него факторов.
Также признаком многих, особенно злокачественных, опухолей я является
анаплазия ткани, возвращение ее к более примитивному типу.
Для морфологической анаплазии характерна утрата опухолевой тканью
особенностей, характерных для исходных дифференцированных тканей. Степень
анаплазии может нарастать в ходе развития опухолей.
Наряду с морфологической анаплазией можно говорить о функциональной
анаплазии – частичной или полной утрате опухолевой тканью способности
выполнять специфические функции, характерные для соответствующей нормальной
ткани: секреторные, сократительные и т.д..
Биохимическая анаплазия проявляется в исчезновении из опухолевых
клеток части, или всех специфических ферментов, характерных для исходных
клеток. Так, в клетках анаплазированных гепатом не выявляются многие
ферменты, специфические для нормальной печеночной клетки.
Наряду с исчезновением белков, характерных для ткани взрослого
животного, в некоторых типах опухолей возобновляется синтез белков,
специфичных для эмбриона. Наиболее ярким примером является возобновление
синтеза эмбрионального альфа-фетопротеина клетками гепатом человека и
животных.
Иммунологическая анаплазия проявляется в исчезновении из опухолевых
клеток ряда антигенов, типичных для нормальных клеток того же типа
(антигенное упрощение).
Инвазивный рост – способность опухолевой ткани врастать в окружающие
ткани и, разрушая, замещать их. Это – характерная черта злокачественности.
Метастазирование также принадлежит к числу наиболее характерных
отличительных особенностей злокачественных опухолей. Основными этапами
попадание их в кровеносный или лимфатический сосуд, циркуляцию этих клеток
в крои, или лимфе, прилипание клеток к сосудистой стенке и образование
опухолевого эмбола, выход клеток из сосуда и пролиферацию их с образованием
метастатического узла.
ОНКОГЕНЕЗ.
Инициация онкогенеза - это процесс, в ходе которого химические,
физические и биологические агенты изменяют определенные элементы генома
клетки-мишени. Для того чтобы изменения, произошедшие во время инициации
онкогенеза, закрепились, необходимо, чтобы осуществилась репликация ДНК
клетки. Мутации определенных генов могут изменить свойства клеток.
Изменения генома в первую очередь затрагивают гены, ответственные за
основные жизненно важные функции клеток. Для возникновения рака
недостаточно единичной мутации, а необходимы изменения в нескольких (не
менее двух) генах, один из которых обеспечивает иммортализацию (бессмертие)
клеток, а другой - развитие злокачественного фенотипа.
Промоция онкогенеза - это стадия, которая характеризуется увеличением
популяции инициированных клеток и дальнейшими изменениями в их геноме под
влиянием промоторов канцерогенеза, причем последние могут быть как
генотоксическими канцерогенами, так и эндогенными факторами (например,
стимуляция гормонами). Так формируется и увеличивается популяция клеток с
геномными повреждениями, предшествующими их злокачественному перерождению.
При этом возрастает вероятность вторичной мутации в какой-нибудь из клеток
в этой популяции, поскольку делящиеся клетки более чувствительны к действию
мутагенов. Главная особенность стадии промоции - ее обратимость и наличие
концентрационного порога в действии промоторов.
Прогрессия онкогенеза - это активная стадия опухолевого процесса,
когда пролиферация клона трансформированных клеток приводит к образованию
опухоли. Характерные признаки: усиление скорости роста клеток на фоне
снижения дифференцировочного потенциала этих клеток, проявление инвазивных
свойств и способности к метастазированию, нестабильность генома и
хромосомные абберации (изменение числа наборов хромосом или числа отдельных
хромосом, перестройки хромосом). Опухолевые клетки обладают преимуществами
перед нормальными клетками для роста и выживаемости в одинаковых условиях.
Для стадии прогрессии характерны глубинные нарушения уже между опухолью и
организмом.
В опухолевых клетках немного генов с измененной структурой. Все
опухолеспецифические гены проявляются по их измененной экспрессии,
приводящей в итоге к опухолевому фенотипу клеток.
Обнаружено, что в ответ на повреждение структуры ДНК и другие,
стрессовые для клетки воздействия быстро повышается продукция р53, что
может вызывать либо остановку клеточного цикла, либо апоптоз, а
неспособность белка гена р53 дикого типа транслоцироваться в ядро клетки
препятствует функционированию гена в качестве супрессора. Вероятно, именно
эта роль белка р53 в качестве "охранника генома" может обьяснить то
обстоятельство, что ген р53 наиболее часто изменен в опухолях человека.
Несмотря на многочисленные доказательства роли белка р53 в апоптозе,
выявлен ряд других генов, активация которых наблюдается во время р53-
опосредуемого апоптоза. Кроме того, непонятно каким образом проапоптическое
действие белка р53 может реализоваться независимо от транскрипционной
активности этого белка или почему в одних случаях р53 вызывает апоптоз,
тогда как в других происходит только остановка клеточного цикла.
Известно, что при прохождении клетки по циклу в нескольких критических
временных точках после проверки правильности реализации генетической
программы в ответ на действие как внутриклеточных, так и внеклеточных
стимулов клетка может либо завершить митоз, либо остановить клеточный цикл
для репарации повреждений, либо включить механизмы апоптоза. Процесс
клеточного деления происходит в результате циклической и регулируемой во
времени активации специфических ферментов, которые фосфорилируют (и таким
образом регулируют) белки, необходимые для прохождения митоза. Эти
ферменты, называемые циклинзависимыми киназами (CDK), активируются при
связывании с белковым кофактором - циклином, что способствует продвижению
клеток по фазам цикла, и ингибируются специфическими белками (CDK-
ингибиторами или CDI), что препятствует реализации клеточного цикла
Показано, что глюкокортикоидные гормоны, индуцирующие апоптоз, после
связывания с соответствующими специфическими рецепторами клеток-мишеней
действуют на уровне регуляции экспрессии генов, продукты которых
ответственны не только за пролиферацию, но и за апоптоз. Этими продуктами
являются с-Myc, циклин D3 и одна из его каталитических субъединиц - cdk 4,
а также белки рRb и E2F .
Теломераза - клеточный фермент, обеспечивающий восстановление длины
теломерного участка хромосомной ДНК, в большинстве клеток нормальных тканей
отсутствует. В клетках злокачественных опухолей ген теломеразы активен.
Однако, несмотря на то, что экспрессия теломеразы является одним из
характерных маркеров злокачественности клеток, сама по себе она не служит
причиной возникновения рака, поскольку клетки, трансформированные геном
теломеразы, сохраняют нормальный фенотип. Поэтому ингибиторы теломеразы
предполагается использовать для ограничения числа циклов деления опухолевых
Факторы роста
Факторы роста и контролируемые ими механизмы вызывают неудержимую
пролиферацию клеток, их подвижность, инвазивность, ангиогенез и фенотип.
ЭФР - эпидермальный фактор роста играет важную роль в регуляции
жизнедеятельности нормальных и опухолевых клеток. Вызывает устойчивость к
апоптозу.
РЭФР - это трансмембранный клеточный рецептор, синтез которого
кодируется геном с-erb B1. Установлено, что в ряде опухолей человека в
результате амплификации этого гена многократно возрастает синтез
вышеупомянутого рецепторного белка. РЭФР состоит из трех основных
функционально различных доменов: лигандсвязывающего, трансмембранного и
цитоплазматического, обладающего эндогенной протеинкиназной активностью и
катализирующего фосфорилирование белков плазматической мембраны, включая и
сам рецептор, и белков цитозоля, в основном по остаткам тирозина.
Последнему домену отводится важная роль в передаче регуляторного сигнала
внутри клеток-мишеней. При амплификации гена с-erb B1 клетка становится
более восприимчивой к воздействию ростовых факторов и реагирует на
ростстимулирующие субстанции, которые продуцируются интрацеллюлярно. Такой
механизм клеточной саморегуляции, известный как аутокринная петля
регуляторного роста, выводит процесс роста опухолевых клеток из-под влияния
контролирующих систем организма и многими исследователями он
рассматривается в качестве промотора канцерогенеза в солидных опухолях
человека различной локализации и гистогенеза. В одной клетке-мишени может
одновременно активироваться несколько аутокринных петель, гетерогенных по
составу лигандов и их рецепторов. ЭФР-подобные цитокины могут стимулировать
пролиферацию трансформированных клеток также с помощью паракринного
механизма, например, в случае их синтеза нормальными клетками,
соседствующими с опухолевым очагом. Учитывая то, что предшественники
цитокинов семейства ЭФР локализованы в плазматической мембране клеток,
следует иметь в виду и их способность стимулировать пролиферацию
сопредельных клеток по юкстакринному механизму, т.е. когда сигнальная
молекула фактора роста, обладая физиологической активностью еще находясь в
составе плазматической мембраны, может взаимодействовать с клеткой-мишенью.
Сосудистая патология является ключевой в прогрессии некоторых
опухолей, она характеризуется повышенной проницаемостью сосудов для
компонентов плазмы крови и гиперкоагуляцией. К цитокинам, обладающим
выраженным ангиогенным действием, относят ФРЭС, основной и кислый ФРФ,
инсулиноподобный фактор роста I, фактор роста гепатоцитов, ангиопоэтин,
плацентарный фактор роста (ПФР), связываемый гепарином ЭФР, ТФР-бета.
Инвазия. Изменения внеклеточного матрикса и базальной мембраны в
настоящее время рассматривается в качестве важнейших звеньев инвазии
опухолевых клеток. Инвазивный потенциал опухолевой клетки определяется ее
способностью активно мигрировать и вызывать частичную деградацию
соединительной ткани. Миграция клеток осуществляется за счет их
динамического взаимодействия друг с другом и с внеклеточным матриксом.
Трансмембранные белки интегрины связывают внеклеточный матрикс с
цитоскелетом путем образования специальных белковых комплексов. Лигандами
интегринов служат белки внеклеточного матрикса (ламинин, фибронектин), а
цитоплазматические участки интегринов соединены с актиновыми филаментами
цитоскелета с помощью таких белков, как талин, тензин, актинин-альфа. Таким
образом, интегрины опосредуют двунаправленную передачу регуляторных
сигналов из клетки в клетку. С цитоплазматическими доменами интегринов
может взаимодействовать протеинкиназа ILK(integrin-linked kinase),
активность, которой стимулируется после прикрепления клеток к внеклеточному
матриксу.
Другой класс трансмембранных белков, участвующих в образовании
контактов между цитоскелетными структурами клеток - кадгедрины. Они
связываются с микрофиламентами, микротрубочками и промежуточными
филаментами с помощью специальных адапторных белков. При снижении
экспрессии кадгедринов значительно ослабляется межклеточная адгезия и
адгезия к белкам внутриклеточного матрикса, что определяет способность
опухолевых клеток к инвазии.
Cпособность опухолевых клеток при инвазии в окружающие ткани вызывать
частичную деградацию соединительнотканных структур реализуется за счет
активности ряда протеиназ: цистеиновых, сериновых, аспарагиновых и
металлопротеиназ. Последние относятся к семейству, включающему следующие
эндопептидазы: коллагеназу, желатиназу и стромилизины. Активность протеиназ
регулируется специфическими эндогенными ингибиторами, например, тканевыми
ингибиторами металлопротеиназ (TIMP) или ингибиторами активатора
плазминогена (PAI). При инвазии и миграции опухолевых клеток отмечено
координированное действие интегринов не только с металлопротеиназами, но и
с активатором плазминогена урокиназного типа (URA), который является
сериновой протеиназой.
РЕПАРАТИВНАЯ РЕГЕНЕРАЦИЯ.
Репаративная регенерация включает в себя процессы распада поврежденных
клеток, дедифференцировки жизнеспособных клеток и их последующей
пролиферацией (при наличие столовых клеток способность пролиферировать
получают именно они), вторичную дифференцировку, установление межклеточных
связей (интеграцию).
При поранении и разрушении элементов ткани рядом с ними находится
повреждены, именно в этой зоне начнется пролиферация клеток в раневой
очаг. Разрушенная часть сразу же наполняется большим количеством
лейкоцитарных элементов – это воспаление.
В реактивной зоне начинается частичная деградация элементов ткани,
которые в норме являются высокоспецифичными клетками не способными к
делению. После дедифференцировки эти клетки начинают активно
пролиферировать, и все большее количество клеток высаживается в зону
поражения. Достаточную роль в этом процессе и его контроле играет
внеклеточный матрикс или ВКМ, а также matrix metalloproteinases или ММР. В
качестве примера этого влияния я приведу процесс заживления ран кожи.
Контроль во время ремодулирования ВКМ ведет к дифференцировки и
редифференцироке (а). В нормальном эпидермисе клетки расположены на
базальной мембране, которая отделяет их от подлежащей стромы(серая) ВКМ.(b)
Ранение: кератиноциты взаимодействуют с нативным коллагеном I и индуцируют
экспрессию ММР-1ю (с) Миграция: ММР-1 деградирует фибриллярный коллаген,
чтобы открыть скрытые сайты и индуцировать миграцию. (d) Локальная
деградация внутри, фибринового, сгустка вносит свой вклад в миграцию
кератиноцитов. (е) Синтез базальной мембраны супрессирует экспрессию. ММР-
1. (а) Даминин-5 (LM-5) ремодулирует с помощью плазмина индуцирует
образование гемидесмосом и стабилизирует эпителиальные взаимодействия с
базальной мембраной.
Базальные кератиноциты располагаются на базальной мембране. Вследствие
повреждения запускается цепь событий приводящих к миграции базальных
кератиноцитов, которые реэпителизируют рану. Одним из первых изменений
является нарушение кератиноцит-ВКМ взаимодействия на раневом крае, где
клетки, мигрирующие под базальную мембрану, подвергаются воздействию
дермальных коллагенов. В результате взаимодействия фибриллярного коллагена
с кератиноцитом?2?1 интегрин быстро запускает экспрессию ММР-1
(collagenase-1), которая затем взаимодействует с активированными
рецепторами epidermal growth factor (EGF). ММР-1 денатурирует фибриллярный
коллаген I, расщепляя? 1 и?2 цепи в специфических последовательностях
распознавания аминокислот, тем самым редуцирует их адгезивную функцию и
экспозирует сайты внутрь ВКМ для создания более благоприятной среды для
миграции. ММР-7 вовлекается в репарацию легких, но не ММР-1 и ММР-3
(stromelysin-1).
Ремоделирование ВКМ необходимо для проведения стоп-сигнала для миграции
кератиноцитов и запуска последующей ре-эпителизации. Базальная мембрана под
базальными кератиноцитами содержит ламинин-5б который обеспечивает
существенную структурную интеграцию с эпидермисом путем связывания
гемидесмосом в кератиноцитах с коллаген VII-содержащими якорными фибриллами
подлежащего дермиса. Ламинин-5 секретируемый подвижными трансформированными
клетками, содержит не подвергшуюся процессингу форму?3 субъединицы,
которая неспособна поддерживать сборку гемидесмосом, но пригодна для
миграции. Плазминоген связывается с этой субъединицей ламинина и после
активации с помощью tissue-type plasminogen activator (tPA) расщепляет
ламинин на более короткую форму, которая способствует сборке гемидесмосом и
теряет подвижность. Таким образом, ремоделирование ламинина может
превращать его из ВКМ белка, который управляет подвижностью, в адгезивную
форму, которая способствует дифференцировке. При заживлении ран плазминоген
необходим не только для конверсии ламинина, но также и для кератиноцитов,
проникающих в фибриновый сгусток, во время их миграторной фазы. Итак
продолжим. После фазы сверхактивной пролиферации наступает фаза вторичной
диффиренцировки, при которой происходит восстановление нормальной структуры
ткани. И последним этапом заживления можно назвать установление клеточных
контактов или интеграцию.
Вполне можно было бы ограничится такой схемой, но она применима для
однородной ткани, где все клетки - одой природы, но в организме гораздо
больше тканей, где одновременно существуют разной природы клетки. Таким
примером является печень, где наряду с гепатоцитами присутствую клетки
соединительно-тканной природы - фибробласты. При повреждении разных типов
клеток в одном органе, в норме при регенерации наш организм старается при
восстановлении выдержать их исходное соотношение. Однако, если на ту же
печень постоянно и часто оказывать какое-то повреждающее воздействие, то
преимущество будет у фибробластов, которые пролиферируют быстрее. В этом
случае печень зарастает соединительно-тканными рубцами и уже не может
выполнять свою функцию (цирроз печени).
Также при репарации наблюдается явление прорастания кровеносных
сосудов в регенерирующие ткани, в те места, где их в норме быть не должно.
Это необходимо для обеспечения прлиферирующих клеток кислородом и другими
необходимыми веществами.
Репаративная регенерация: 1- протекает локально, 2-начинается после гибели
большей, чем обычно массы ткани, 3-фазы «пролиферации» и
«дифференцировки» последовательны и коррелированы. Если дефект замещается
тканью идентичной ранее бывшей, то такой способ репаративной регенерации
относят к ПОЛНОЙ. Если зона дефекта замещается другой тканью (обычно
соединительной), то регенерацию называют НЕПОЛНОЙ. При этом возмещение
массы и структуры достигается через регенерационную гипертрофию.
Как известно, при научном изложении материала нельзя использовать один и
тот же термин при описаниях разнокачественных явлений. Термин
«пролиферация» исторически закрепился для обозначения одной из фаз
воспаления. Отсюда этот термин нельзя использовать при описании
регенерации. Именно поэтому в нашей лекции он взят в кавычки. Для фазы
регенерации нужно придумать другой термин. Среди частных примеров по
разделу репаративной регенерации клиницисту важнее всего разбираться в
заживлении ран. Всего описывается четыре способа заживления ран, но
наибольшую значимость имеют два: «путем первичного» и «путем вторичного
натяжения»
ФАКТОРЫ РОСТА.
ИНГИБИТОРЫ РОСТА.
Регенерация - это сложный процесс на который влияют множество
факторов стимулирующих и угнетающих пролиферацию, влияющих на рост,
дифференцировку и интеграцию. Ниже изложенные факторы действуют не только в
процессе репарации, но и в процессах эмбрионального гистогенеза, при росте
тканей в постнатальном развитии.
ЭПИДЕРМАЛЬНЫЙ ФАКТОР РОСТА – этот фактор я является одним из самых
активных митогенов среди известных полипептидных факторов роста. ЭФР с
молекулярной массой 6045 Да, состоит из 53 аминокислотных остатков. Он
может играть важную роль в индукции регенерации печени, осуществляя свое
регуляторное влияние вместе с другими полипептидными факторами роста, среди
которых в первую очередь следует назвать инсулин и гюкагон. ЭФР в
комбинации с инсулином и дексамиметазоном стимулирует пролиферацию
фибробластов, хондроцитов. На карциному А431 ЭФР влияет достаточно не
стандартно – здесь не трансформированный ЭФР является не катализатором, а
ингибитором пролиферации.
ФАКТОР РОСТА НЕРВОВ - молекулярная масса мономера - 13259 Да,
следует подчеркнуть, что он по первичной структуре близок к проинсулину.
ФАКТОР РОСТА ФИБРОБЛАСТОВ - молекулярная масс ФРФ 13400 Да. Он
стимулирует пролиферацию глиальных клеток, миобластов, хондроцитов, клеток
надпочечников. Ускорение митозов в клетках миобластов этим факторов
задерживает их дифференцировку, то же происходит и с хондроцитми.
Существуют также другие полипептидные факторы роста такие как, -
мезодермальный фактор роста, состоящий из группы полипептидов с
молекулярной массой около 2600 Да. Он стимулирует пролиферацию фибробластов
роговицы и играет важную роль в процессе регенерации роговицы. Фактор роста
кости имеет молекулярную массу 83000 Да, чувствителен к трипсину,
стимулирует пролиферацию клеток костей.
Наряду с полипептидными факторами роста описан целый ряд полипептидных
ингибиторов пролиферации клеток. Ингибиторы пролиферации клеток ранее чаще
именовали кейлонами. Эти вещества существенно различаются по молекулярной
термолабильности и иным свойствам. Кейлоны считаются ткане специфичными
регуляторами пролиферации, то есть образуются и проявляют свое ингибирующее
действие в одних и тех же тканях и не имеют выраженной видовой
специфичности. Предполагается, что каждый тип клеток образует свой
специфичный ингибитор пролиферации. Хотя для некоторых клеток известно
несколько таких веществ. Также ингибитором пролиферации клеток является
плотность их «населения». Для каждой ткани она специфична, и если при
регенерации происходит активное деления, то клетки делятся лишь до тех пор,
пока их количество будет в норме, после достижения оптимального количества
клеток пролиферация ингибируется.
Репарация ткани и
раковое перождение.
После того как более или менее детально разобраны процессы репарации и
онкогенеза можно перейти к их сравнению. Для сравнения этих двух процессов
я сначала скажу о некоторой общности опухолевых клеток и клеток
пролиферирующих в процессе репарации.
Для опухолевых клеток помимо описанных выше особенностей характерно
также наличие вариаций в соотношении объем ядра/объем клетки. В раковых
клетках постоянства этого соотношения не существует, так как интенсивно
делящиеся клетки опухоли просто не успевают «наращивать» нужный объем
цитоплазмы. Подобное явления наблюдается также и в процессе репарации
ткани, по той же самой причине.
Так же в процесс репарации наблюдается некоторая степень анаплазии,
поскольку чтобы клеткам с высокой степенью дифференцировки приобрести
способность к делению им просто, необходимо, дегенерировать
(дедиффиренцироваться), то есть для них характерна морфологическая
анаплазия. Так же пролиферирующие клетки не способны вырабатывать
специфичные ферменты, а значит в некоторой степени для них характерна
биохимическая анаплазия. Однако, в отличие от опухолевых клеток с течением
времени степень анаплазии не только не растет, а уменьшается и к окончанию
репарации анаплазия исчезает совсем.
Если сравнивать автономность, которая так характерна для опухолевых
клеток, то для колонии клеток, которая образуется в процессе репарации
автономность не характерна совсем. Этот клон целиком зависит от организма,
от индуцированных им факторов роста, от индуцированных им ингибиторов
пролиферации.
Также клон клеток, который образовался в процессе репарации крайне
нуждается в кислороде, для активного клеточного дыхания. Поэтому в область
поражения достаточно скоро прорастают капилляры. Для опухоли тоже
характерен такой процесс, однако, она сама «контролирует» количество
сосудов, которое ей необходимо. К тому же одной из особенностей опухолевых
клеток является то, что они в какой то мере способны к анаэробному дыханию,
что позволяет среднестатистической клетки опухоли находится дальше от
капилляра, по сравнению с любой не трансформированной клеткой.
Еще одно сходство заключается в том, что наиболее активированными как
в опухоли, так и в ране являются периферические клетки. Именно им присущи
наибольшая дедифференцировка и наибольшая пролиферативная активность.
Приведенные выше данные о сходстве роста клеток при регенерации
эпителия и при опухолевом росте хорошо известны. Но сущность их не
удавалось до сих пор удовлетворительно объяснить.
Можно отметить черты сходства в закономерностях установленных для
роста клеток при репаративной регенерации и новообразований. Прежде всего,
это относится к явлению активации. Сходство в том, что активация во всех
рассматриваемых случаях связана с увеличением свободной поверхности (в
случаях репаративной регенерации и новообразований это краевые клетки, не
связанные или слабо связанные с другими клетками). Чем меньше связаны
клетки организма, тем более выражена активация.
Так как основной причиной активирования клеток является увеличение их
свободной поверхности, то расположение клеток в организме не должно
допускать подобной возможности. Посмотрим внимательно и увидим, что вся
структурная организация нашего организма очень упорядочена, а клетки имеют
строго направленный рост, ведущий обязательно к уменьшению и к полному
исчезновению свободных, энергетически активных поверхностей. Так, клетки
всех органов и тканей между собой соединены, склеены, благодаря чему у них
нет свободных поверхностей. По мере нарастания прочности соединения клеток
тормозится их рост и увеличивается одновременно выраженность
дифференцировки. Округлая или овальная форма всех органов и организма в
целом обеспечивают замкнутую по кругу непрерывность соединений клеток между
собой без образования свободных поверхностей.
Кроме того, в организме имеются различные оболочки в виде фасций, мембран,
капсул и др. образований, которые укутывают группы клеток, органы, ткани и
тесно с ними склеены. Соприкасающиеся с внешней средой клетки также покрыты
или оболочками, или высыхающими, отторгающимися слоями клеток. Все это
обеспечивает не только строгую упорядоченность и стабильность структур
организма с отсутствием или минимальными уровнями свободной поверхности
клеток и, соответственно, низкой свободной энергией, но и является надежным
механизмом самоограничения и саморегуляции роста клеток.
В случае ранений, изъявлений или других дефектов тканей в процессе
репаративной регенерации по краю ран образуются зоны активированных клеток,
но сохраняющих связи между собой, так и строгую направленность роста. По
мере заполнения раневого дефекта и склеивания клеток с исчезновением у них
свободных краев, исчезает активация клеток и связанная с ней
дедифференцировка и восстанавливается непрерывность структуры ткани.
В тех случаях, когда поверхности в какой-то степени свободны или
полностью свободны, особенно когда клетки расположены неупорядоченно, они
становятся сильно активированными (возбужденными). И если при этом их рост
не может быть строго направленным, то он становится неограниченным,
опухолевым.
Имеются прямые доказательства, что клетки в раковых опухолях связаны между
собой значительно более рыхло, чем в соответствующих здоровых тканях.
Помимо способности к неограниченному росту, опухолевые клетки имеют еще
несколько способностей совершенно не свойственных репарирующим клеткам –
это способность к инвазии и метастазированию. Для злокачественных клеток и
то и другое крайне важно, с помощью этих приспособлений клетки опухоли
заселяют организм.
Некоторые ученые выделяют такой процесс, как гиперрегенерация,
которая в конечном итоге ведет к образованию опухоли.
Значительное преобладание новообразования ткани над ее гибель выражается в
период роста и развития в ПОРОКАХ РАЗВИТИЯ и УРОДСТВАХ (закономерности их
развития пока не известны). Гиперрегенерация как избыточное новообразование
ткани при возмещении потерь можно называть ГИПЕРПРОДУКЦИЕЙ. («дикое мясо»
в ранах, экзостозы вместо сращения перелома и др.)
В патологии часто встречаются ситуации, когда гибель ткани
малозаметна, а вот ее новообразование идет узлами. Возникновение таких
узлов начинается из особых «предельных состояний ткани – сфероидов». На
фазе «пролиферации» из «сфероидов» возникают радиально лучисто симметричные
системы конусовидных солидных масс клеток (рис 8), которые
дают начало своему сектору новообразования тканей. В ситуациях, когда
фаза «пролиферации» протекает очень быстро, возникают узлы резко
деформированных тканевых структур четко отграниченные от предсуществующих
тканей – т.н. «доброкачественные опухоли». В случаях когда «сфероид»
выходит за пределы регенерации начинается процесс особого дискретного
тканевого роста – «истинно опухолевый рост».
Основная часть вывода представлена в таблице1. Однако, хотелось бы
сказать, что наибольшее сходство между процессом репарации и
доброкачественной опухолью, где анаплазия выражена не столь сильно, а
метастазов и инвазии нет.
Возможно у репарации и за онкогенеза есть еще какие – то общие, еще
не известные нам черты. Возможно некоторые процессы протекают под влиянием
одних и сигналов, возможно в геноме репарирующих клеток включаются такие
же механизмы, что и в геноме опухолевых клеток, тогда когда они выходят из
нормального клеточного цикла и начинают активно пролиферировать. Это пока
еще не известно.
Репарация ткани |
Раковое перерождение.
|Воздействие. |Механическое повреждение ткани, вызывающее |Химическое воздействие или облучение, вирусы. |
| |гибель клеток. | |
|Реакция |Почти сразу, проявляется в воспалении |Латентный период в развитии опухоли обычно |
|организма. | |длится несколько лет. |
|Геном. | не поврежден. |В геноме есть несколько мутаций. |
|4. Пролиферация. |Контролируется организмом. |Деление не контролируемо. |
|5.анаплазия с |Снижается. |Растет. |
|течением процесса | | |
|6. инвазия |К инвазии не способны |Инвазия существует. |
|7. |Не способны |Существует. |
|Метастазирование | | |
Список литературы.
Б. Албертс и др. «Молекулярная биология клетки» Москва, Мир, 1994г.
Б.П. Ахмедов «Злокачественные новообразования» Москва, Медицина, 1984г.
«Биологические основы злокачественного рост» Сборник статей, Москва,
Иностранная литература,1950г.
И.Ф. Сейц, П.Г. Князев «Молекулярная онкология» Москва, Медицина, 1986г.
«Справочник онколога» Москва, Медицина, 1974г.
«Соросовский образовательный журнал»,Г.И. Абелев «Что такое опухоль»,
«Соросовский образовательный журнал»,В.Н. Сойфер «Репарация генетических
повреждений», 8/1997г.
«Соросовский образовательный журнал», Ю.М. Васильев « Социальное поведение
нормальных и а нтисоциальное поведение опухолевых клеток», 4,5/1997г.
«Украинский нейрохирургический журнал», «Онкогенез глиом головного мозга»,
Киев, 9/2000г.
Список литературы.
1. Б. Албертс и др. «Молекулярная биология клетки» Москва, Мир, 1994г.
2. Б.П. Ахмедов «Злокачественные новообразования» Москва, Медицина, 1984г.
3. «Биологические основы злокачественного рост» Сборник статей, Москва,
Иностранная литература,1950г.
4. И.Ф. Сейц, П.Г. Князев «Молекулярная онкология» Москва, Медицина, 1986г.
5. «Справочник онколога» Москва, Медицина, 1974г.
6. «Соросовский образовательный журнал»,Г.И. Абелев «Что такое опухоль»,
7. «Соросовский образовательный журнал»,В.Н. Сойфер «Репарация генетических
повреждений», 8/1997г.
8. «Соросовский образовательный журнал», Ю.М. Васильев « Социальное
поведение нормальных и а нтисоциальное поведение опухолевых клеток»,
9. «Украинский нейрохирургический журнал», «Онкогенез глиом головного
мозга», Киев, 9/2000г.
10. «Краткая медицинская энциклопедия». Москва. Издательство «Советская
энциклопедия». 1989 г
11. «Общая патология человека». Москва. Медицина.1990 г.
12. «врпросы репаративной и физиологической регенерации». Москва. Медиздат.
13. АА Климов. «Гистогенез и регенерация ткани». Ленинград. Медицина. 1984
14. АТ Бабаева.« Иммунологические механизмы регуляции восстановительных
процессов». Москва. Медицина. 1972 г.
15. СИ Кусень, РС Стойка. «Молекулярные механизмы в действии полипептидных
факторов роста». Москва. Наука. 1985 г.
Действующее вещество: 10 г диоксометилтетрагидропиримидина.
Вспомогательные вещества: вазелин медицинский, ланолин безводный, вода для инъекций.
Фармакологические свойства:
Фармакодинамика. Обладает анаболической и антикатаболической активностью. Ока-зывает противовоспалительное действие. Нормализуя нуклеиновый обмен, ускоряет процессы клеточной регенерации в ранах, ускоряет рост и грануляционное созревание ткани и эпителизацию. При наруж-ном применении обладает фотопротекторными свойствами.
Показания к применению:
Вялозаживающие раны, (термические, химические, луче-вые), буллезные дерматиты. Метилурацил может использоваться с про-филактической целью для предупреждения реакций кожи при облуче-нии новообразований с невысокой радиочувствительностью, уменьше-ния и поздних сращений стенок (окклюзии) влагали-ща - в случае новообразований гениталий.
Способ применения и дозы:
Наружно. Местно. Для лечения острых буллезных лучевых дерматитов, ожогов, ран и язв препарат применяют наружно, который совместим с наружными аппликациями сульфаниламидов, антибиотиков и антисептических средств.
Мазь наносят на поврежденные участки тонким слоем в коли-честве по 5 - 20 г ежедневно в течение 15-30 дней. В случае лучевой терапии новообразований гениталий для профи-лактики и лечения радиоэпителиита мазь используют в рыхлых тампо-нах. Курс лечения индивидуален.
Особенности применения:
Применение при беременности и период лактации - применение препарата в периоды беременности и лактации воз-можно только в том случае, когда предполагаемая польза для матери превышает потенциальный риск для плода и ребенка.
Побочные действия:
Аллергические реакции в виде зуда, гиперемии и кратковремен-ного жжения.
Взаимодействие с другими лекарственными средствами:
Препарат совместим с наружными аппликациями антибактериаль-ных и антисептических средств.
Противопоказания:
Повышенная чувствительность к препарату, избыточность грану-ляций, детский возраст.
С осторожностью - беременность и период лактации.
Условия хранения:
Список Б. В сухом месте при температуре не выше 15 °С. В недоступном для детей месте. Срок годности 3 года 6 мес. Не использовать после истечения срока годности, указанного на упаковке
Условия отпуска:
Без рецепта
Упаковка:
Мазь для местного и наружного применения 10%. 25 г помещают в тубы алюминиевые. Каждую тубу вместе с инструкцией по применению помещают в пачку.
Регенерация костной ткани обусловлена биологическим процессом обновления костной структуры в организме, которая способна разрушаться в результате изнашивания, различного рода повреждений и гибели клеточных тканей. Регенерация может быть репаративной и физиологической, когда восстановительные процессы тканевой структуры, в результате естественных возрастных изменений, в здоровом организме происходят достаточно медленно и не сопровождаются стрессовыми ситуациями.
Механизм костной регенерации
Переломы и повреждения кости, как правило, всегда сопровождаются повреждениями близлежащих мягких тканей, что провоцирует местную и общую ответную реакцию организма. В восстановительном периоде костная ткань претерпевает ряд сложных (общих) и местных (биологических и биохимических) изменений, которые напрямую зависят от таких факторов, как возраст пострадавшего, нарушение кровоснабжения ткани, качества лечебных мероприятий и состояния иммунной системы пациента. Механизм репаративных и физиологических регенераций протекает с общими закономерностями. Усиленное физиологическое восстановление тканей в той или иной мере пересекается с репаративными регенерациями.
Репаративный процесс предусматривает регенерацию потерянной в результате травмы или поврежденной ткани. В этих случаях качество и степень восстановительного процесса незначительно отличаются друг от друга. Например, при поражении нервной и мышечной ткани способность к ее полному восстановлению значительно ниже, чем костной, и чаще всего анатомически замещается образовавшимся соединительным рубцом. При повреждении костных тканей происходит поэтапный репаративный процесс с восстановлением анатомической формы, гистологической структуры и функциональности кости.
Главным принципом ремоделирования является не только восстановление после различных травм и повреждений, но и разрушение костной ткани, что обусловлено естественными процессами, происходящими в здоровом организме для удаления старой ткани и формирования новой. Полный цикл ремоделирования в среднем составляет от 40 до 180 дней.
Основные источники регенерации
Нормализация целостности ткани происходит при помощи клеточной пролиферации (рост клеток), в первую очередь, остеогенного (внутреннего) слоя надкостницы и эндоста (тонкой соединительнотканной оболочки, выстилающей полость костного мозга).
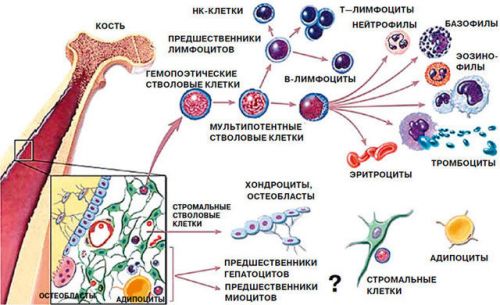
Клетки, участвующие в тканевой костной регенерации
Современное представление о регенерации костных тканей сочетает в себе метапластическую (превращение клеток других тканей эндометрий при определенных условиях) и неопластическую (новый рост) теории. Такие процессы могут развиваться в остеоцитах, остеобластах, фибробластах, лимфоцитарных, эритроцитарных и других преостеогенных клетках.
Стадии восстановления
Восстановительный цикл условно разделяется на 4 этапа:
- начальная стадия сопровождается репродукцией (выработкой) элементов клеток, обусловленной действием продуктов некробиоза и некроза в поврежденных клетках и тканях. На этом этапе важно образование костной мозоли и нормализация процесса кровообращения в месте повреждений (травмы, переломов и т.д.);
- на второй стадии осуществляется образование тканевой структуры, что обеспечивается действием анаболических гормонов. Клетки кости образуют специфическую основу, состоящую из костного регенерата. При благоприятных условиях (отсутствие хронических болезней, хорошая иммобилизация и т.д.) образуется остеоидная ткань;
- третья стадия сопровождается образованием костной структуры с полным восстановлением локального кровообращения и минерализации белкового регенерата. Образованное свободное пространство между отломками тканей заполняется костными трабекулами, которые составляют пластинчатые и грубоволокнистые ткани кости. На заключительном этапе костная сеть объединяется, образуя широкий костный канал;
- в заключительной фазе происходит полная перестройка основы регенерата с четким выделением кортикального слоя, восстановлением костномозгового канала и четко выраженной надкостницей. Хаотичное расположение обызвествленных структур заменяется повышенным образованием напластованного регенерата.
Несмотря на то, что сращение костной ткани происходит стадийно, разделение на этапы не имеет существенного значения, потому что в результате они вполне перекрываются между собой. Например, при идеальной фиксации и репозиции костной ткани чаще всего активизация различного вида клеток происходит практически одновременно, что значительно затрудняет разграничение стадийности репаративных процессов. Тем не менее, при выборе оптимальной тактики лечения особенности развития стадий обязательно следует учитывать.
Регенерация при переломах
При классическом, неосложненном переломе и неподвижности костных отломков достаточно часто отмечается первичное костное сращение, начальная стадия которого сопровождается врастанием сосудов и новообразованных мезенхимальных элементов в область поражения или гематомы. В этом случае образуется мозоль, состоящая из соединительных тканей, в которой практически сразу начинает образовываться костная ткань.
Далее предварительная мозоль созревает, преобразовываясь в зрелые пластинчатые кости, что приводит к появлению истиной костной мозоли, главным отличием которой является беспорядочное расположение костных перекладин. После выполнения костью своих функций возникает статическая нагрузка и новообразованная ткань при участии остеобластов и остеокластов подвергается перестройке. В это время восстанавливается иннервация, васкуляризация, а также появляется костный мозг.
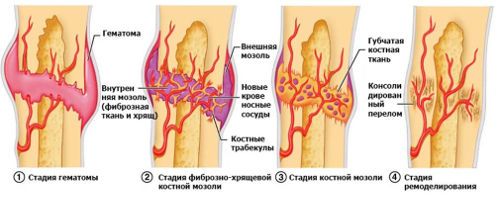
Этапы регенерации костной ткани после перелома
При неблагоприятных местных условиях, а также диафизарных переломах, развивается вторичное костное сращение, характеризующееся образованием между отломками костей хрящевой ткани, которая стоит в основе строения кости. Именно поэтому вторичное сращение считается предварительно образованной костно-хрящевой мозолью, со временем превращающейся в полноценную кость. Важно учитывать, что вторичное сращение ткани встречается намного чаще, чем первичное, но требует более длительного восстановительного периода.
При неблагоприятном течении процесса регенерация костных тканей может нарушиться. Например, задержка восстановления замедляется при инфицированных ранах, когда процесс нагноения обостряет воспалительный процесс, тем самым затормаживая регенеративное восполнение ткани. В некоторых случаях образование первичной костно-хрящевой мозоли не преобразовывается в костную основу, сопровождаясь подвижностью сломанных осколков кости, что приводит к образованию ложного сустава. В то же время следует учитывать, что при избыточной продукции костной ткани регенерация может сопровождаться появлением экзостозов (костных наростов).
Как правило, регенеративные процессы в хрящевой ткани развиваются неполно, в отличие от костной ткани. Замещаются только легкие дефекты за счет хондробластов, которые и создают активное вещество хрящевой ткани с последующим их преображением в хрящ. При крупных дефектах хрящей наблюдается разрастание рубцовой ткани.
Этапы регенерации могут плавно переходить друг в друга, что позволяет сделать следующие выводы:
- для достижения идеальной фиксации и репозиции костных отломков необходимо как можно быстрее предпринять все необходимые меры до того, как возникнет дифференцировка клеток;
- при поздней репозиции все вмешательства по корректировке обломков могут вызвать повторное разрушение капилляров регенерата и нарушения остеогенеза;
- для стимулирования нарастания пластинчатых костей требуются функциональные нагрузки, что обязательно следует учитывать в дальнейшей терапии пациентов.

Фото несовершенного остеогенеза с характерной хрупкостью костей
Регенерация костной ткани при переломе в большей степени зависит от того, насколько сильно разрушена кость, местных условий (кровообращение, воспалительные процессы и т.д.), а также смещения отломков.
Виды репаративной регенерации костных тканей
Специалисты условно разделяют регенерацию костной ткани на определенные виды и фазы:
Первичная
Эта фаза требует создания особых условий и развивается за достаточно короткое время и заканчивается образованием интермедиарной мозоли. Первичный вид регенерации встречается чаще всего при компрессионных и забойных повреждениях костей, а также при расстоянии между обломками от 50 до 100 мкм.
Первично-замедленная
Такой вид сращения отмечается в том случае, когда неподвижные обломки плотно прижаты друг к другу, без дополнительного пространства. Первично-замедленное сращение проходит исключительно по сосудистым каналам, что приводит к частичному сращению, в то время как полное межкостное сращивание требует совмещения костных обломков. Многие специалисты считают такой вид репарации достаточно эффективным.
Вторичная
Вторичное сращение аналогично процессу заживления раневой поверхности мягкой ткани, однако между ними существуют отличительные особенности. Заживление ран мягкой ткани обусловлено вторичными натяжениями и, как правило, итогом становится образование рубцов. Репарация клеток при переломе задействует весь костный материал и заканчивается образованием полноценных костей. Однако важно учитывать, что для вторичного срастания кости необходимо обеспечение надежной фиксации отломков. При ее отсутствии или плохо проведенном подготовительном этапе клетками будут пройдены 2 фазы (фибро- и хондрогенез), после чего переломы заживут, но кость может окончательно не срастись.
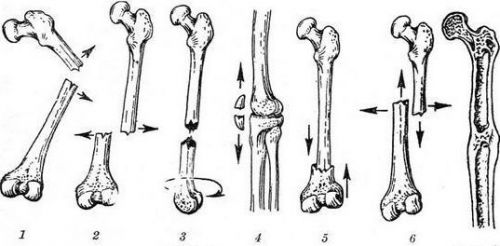
Характерные смещения отломков кости
Качество проведенного лечения определяется характером образовавшейся мозоли на контрольном рентгенологическом снимке. На плохую фиксацию отломков кости указывает большой размер мозоли.
Препараты, стимулирующие восстановление
Использование стимулирующих регенерацию кости препаратов тесно взаимосвязано с определенными репаративными стадиями. Например, на начальном этапе рекомендуется прием лекарственных средств, действие которых направлено на улучшение обмена веществ и клеточной инфильтрации. Кроме того, при образовании пластинчатых костей огромное значение принадлежит нагрузкам на костные сегменты.
Для ускорения процесса восстановления структур рекомендуется применение следующих средств и методик лечения:
- эффективным воздействием обладает локальный массаж и дозированные динамические нагрузки на травмированную конечность;
- ИК и УВЧ, при которых направленная доза излучения способствует активизации восстановительных процессов пораженной области;
- электрофорез с добавлением лекарственных препаратов, магнитотерапия, электростимуляция, оксибаротерапия;
- для ускорения регенерации рекомендуются медикаментозные препараты (Цистеин, Метионин, Карбоксилин, Ретаболил, Кальцитрин, Тиреокальцитонин, витамины, и т.д.);
- при необходимости назначается аутогемотерапия, некрогормонотерапия и т.д.
Важно учитывать, что такие способы стимуляции регенеративных процессов, как магнито- и лазеротерапия, теоретически не объяснимы, однако практика показывает их положительное воздействие на срастание поврежденных костей.
Заживление переломов губчатых костей протекает с некоторыми особенностями. Прочность (механическая) губчатых костей в большинстве случаев определяется костными балками, которые располагаются в эндостальной зоне, а не в кортикальном слое. Оптимальными условиями регенерации губчатой костной ткани является максимальное сближение отломков кости (при вколоченном переломе). Вколачивание костных отломков возможно при помощи компрессионного аппарата, который позволяет сопоставить костные фрагменты даже при большом расстоянии между ними.

Специальный аппарат (Пустовойта) позволяет самостоятельно дозировать нагрузку на конечности при помощи пульта управления
Периостальные мозоли во время заживления губчатых костей слабо выражены. В этом случае регенерация полностью зависит от внутренних (возрастная категория пациента, нормализация обменных процессов, гормональный статус и т.д.).
Критерии успешности регенерации
На успешность проведенных мероприятий указывают следующие показатели:
- субъективные показатели – у пациента отсутствуют жалобы на болевую симптоматику, а также патологическую подвижность при небольших динамических и статических нагрузках и существующая возможность сохранения функциональности конечности;
- клинические объективные тесты – при пальпации пациент не ощущает болезненности, в месте перелома отсутствует подвижность при умеренных продольных нагрузках. Кратковременная статическая нагрузка на больную конечность составляет 80% от всей величины нагрузок здоровой конечности;
- рентгенологические критерии – отмечается отсутствие межфрагментарных щелей, близких к однородной плотной костной мозоли. При этом восстановительная стадия в костномозговом канале и кортикальном слое соответствует уровню перелома.
Необходимо учитывать, что вопрос об эффективности и необходимости стимулирования репаративных процессов с теоретической точки зрения до сих пор не решен. Однако попытки ускорения регенерации предпринимаются до настоящего времени. При этом важно помнить, что сращивание переломов ускоряется при благоприятных условиях (надежная фиксация обломков кости, полноценное сбалансированное питание, нормализация обменных процессов в организме и т.д.).
При невыполнении хотя бы одного фактора репаративный процесс протекает с нарушениями, а кость, вне зависимости от вида стимуляции, может не срастись, несмотря на прилагаемые усилия. Немаловажное значение имеет своевременное обращение к врачу. Даже при небольшом повреждении кости требуется тщательная диагностика и последующее контролирование процесса регенерации костной ткани.
Репарация - это свойство живой клетки бороться с различными повреждениями ДНК. В окружающем мире существует множество факторов, способных вызвать необратимые изменения в живом организме. Чтобы сохранить свою целостность, избежать патологических и несовместимых с жизнью мутаций, должна существовать система самостоятельного восстановления. Как нарушается целостность генетического материала клетки? Рассмотрим этот вопрос более подробно. Также выясним, какие существуют восстановительные механизмы организма и как они работают.
Нарушения в ДНК
Молекула дезоксирибонуклеиновой кислоты может быть разорвана как в ходе биосинтеза, так и под влиянием вредных веществ. К негативным факторам, в частности, относят температуру или физические силы различного происхождения. Если разрушение произошло, клетка запускает процесс репарации. Так начинается восстановление исходной структуры За репарацию отвечают особые ферментные комплексы, присутствующие внутри клеток. С невозможностью отдельных клеток осуществлять восстановление связаны некоторые заболевания. Наука, изучающая процессы репарации, - это биология. В рамках дисциплины проведено достаточно много опытов и экспериментов, благодаря которым становится более понятным процесс восстановления. Надо отметить, что механизмы репарации ДНК очень интересны, как и история открытия и изучения данного феномена. Какие факторы способствуют началу восстановления? Для того чтобы процесс запустился, необходимо, чтобы на ДНК воздействовал стимулятор репарации тканей. Что это такое, подробнее расскажем чуть ниже.
История открытия
Это удивительное явление начал изучать американский ученый Кельнер. Первым значимым открытием на пути исследования репарации стал такой феномен, как фотореактивация. Этим термином Кельнер назвал эффект снижения вреда от ультрафиолетового облучения при последующей обработке поврежденных клеток ярким излучения видимого спектра.
"Световое восстановление"
Впоследствии исследования Кельнера получили свое логическое продолжение в работах американских биологов Сетлоу, Руперта и некоторых других. Благодаря труду этой группы ученых было достоверно установлено, что фотореактивация является процессом, который запускается благодаря особому веществу - ферменту, катализирующему расщепление димеров тимина. Именно они, как выяснилось, образовывались в ходе экспериментов под воздействием ультрафиолета. При этом яркий видимый свет запускал действие фермента, который способствовал расщеплению димеров и восстановлению первоначального состояния поврежденных тканей. В данном случае речь идет о световой разновидности восстановления ДНК. Определим это более четко. Можно сказать, что световая репарация - это восстановление под воздействием света первоначальной структуры ДНК после повреждений. Однако данный процесс не является единственным, способствующим устранению повреждений. 
"Темновое" восстановление
Спустя некоторое время после открытия световой была обнаружена темновая репарация. Это явление происходит без какого-либо воздействия световых лучей видимого спектра. Данная способность к восстановлению обнаружилась во время исследования чувствительности некоторых бактерий к ультрафиолетовым лучам и Темновая репарация ДНК - это способность клеток убирать любые патогенные изменения дезоксирибонуклеиновой кислоты. Но следует сказать, что это уже не фотохимический процесс, в отличие от светового восстановления.
Механизм "темнового" устранения повреждений
Наблюдения за бактериями показали, что спустя некоторое время после того, как одноклеточный организм получил порцию ультрафиолета, вследствие чего некоторые участки ДНК оказались поврежденными, клетка регулирует свои внутренние процессы определенным образом. В результате измененный кусочек ДНК просто отрезается от общей цепочки. Получившиеся же промежутки заново заполняются необходимым материалом из аминокислот. Иными словами, осуществляется ресинтез участков ДНК. Открытие учеными такого явления, как темновая репарация тканей, - это еще один шаг в изучении удивительных защитных способностей организма животного и человека. 
Как устроена система репарации
Эксперименты, позволившие выявить механизмы восстановления и само существование этой способности, проводились с помощью одноклеточных организмов. Но процессы репарации присущи живым клеткам животных и человека. Некоторые люди страдают пигментной ксеродермой. Это заболевание вызвано отсутствием способности клеток ресинтезировать поврежденную ДНК. Ксеродерма передается по наследству. Из чего же состоит репарационная система? Четыре фермента, на которых держится процесс репарации - это ДНК-хеликаза, -экзонуклеаза, -полимераза и -лигаза. Первый из этих соединений способен распознавать повреждения в цепи молекулы дезоксирибонуклеиновой кислоты. Он не только распознает, но и обрезает цепь в нужном месте, чтобы удалить измененный отрезок молекулы. Само устранение осуществляется с помощью ДНК-экзонуклеазы. Далее происходит синтез нового участка молекулы дезоксирибонуклеиновой кислоты из аминокислот с целью полностью заменить поврежденный отрезок. Ну и финальный аккорд этой сложнейшей биологической процедуры совершается с помощью фермента ДНК-лигазы. Он отвечает за прикрепление синтезированного участка к поврежденной молекуле. После того как все четыре фермента сделали свою работу, молекула ДНК полностью обновлена и все повреждения остаются в прошлом. Вот так слаженно работают механизмы внутри живой клетки. 
Классификация
На данный момент ученые выделяют следующие разновидности систем репарации. Они активируются в зависимости от разных факторов. К ним относятся:
- Реактивация.
- Рекомбинационное восстановление.
- Репарация гетеродуплексов.
- Эксцизионная репарация.
- Воссоединение негомологичных концов молекул ДНК.
Все одноклеточные организмы обладают как минимум тремя ферментными системами. Каждая из них обладает способностью осуществлять процесс восстановления. К этим системам относят: прямую, эксцизионную и пострепликативную. Этими тремя видами восстановления ДНК обладают прокариоты. Что касается эукариот, то в их распоряжении находятся дополнительные механизмы, которые называются Miss-mathe и Sos-репарация. Биология подробно изучила все эти виды самовосстановления генетического материала клеток.
Структура дополнительных механизмов
Прямая репарация — это наименее сложный способ избавления от патологических изменений ДНК. Ее осуществляют особые ферменты. Благодаря им восстановление структуры молекулы ДНК происходит очень быстро. Как правило, процесс протекает в течение одной стадии. Одним из вышеописанных ферментов является O6-метилгуанин-ДНК-метилтрансфераза. Эксцизионная система репарации - это тип самовосстановления дезоксирибонуклеиновой кислоты, который подразумевает вырезание измененных аминокислот и последующую замену их заново синтезированными участками. Этот процесс уже осуществляется в несколько стадий. В ходе пострепликативного восстановления ДНК в структуре этой молекулы могут образовываться бреши величиной в одну цепочку. Затем они закрываются при участии белка RecA. Пострепликативная система репарации уникальна тем, что в ее процессе отсутствует этап распознавания патогенных изменений. 
Кто отвечает за механизм восстановления
На сегодняшний день ученым известно, что такое простейшее существо, как кишечная палочка, обладает не менее чем полусотней генов, отвечающих непосредственно за репарацию. Каждый ген выполняет определенные функции. К ним относят: распознавание, удаление, синтез, прикрепление, идентификацию последствий воздействия ультрафиолета и так далее. К сожалению, любые гены, в том числе и те, что отвечают за процессы репарации в клетке, подвергаются мутационным изменениям. Если это происходит, то они запускают более частые мутации и во всех клетках организма.
Чем опасно повреждение ДНК
Каждый день ДНК клеток нашего организма подвергаются опасности повреждений и патологических изменений. Этому способствуют такие факторы окружающей среды, как пищевые добавки, химические вещества, перепады температур, магнитные поля, многочисленные стрессы, запускающие определенные процессы в организме, и многое другое. Если структура ДНК будет нарушена, это может вызвать тяжелую мутацию клетки, а может в будущем привести к раку. Именно поэтому у организма есть комплекс мер, призванных бороться с такими повреждениями. Даже если ферментам не удается вернуть ДНК в первозданный вид, система репарации работает на то, чтобы свести повреждения к минимуму. 
Гомологичная рекомбинация
Разберемся, что это такое. Рекомбинация являет собой обмен генетическим материалом в процессе разрыва и соединения молекул дезоксирибонуклеиновой кислоты. В том случае, когда в ДНК возникают разрывы, начинается процесс гомологичной рекомбинации. В ходе него осуществляется обмен фрагментами двух молекул. Благодаря этому точно восстанавливается первоначальная структура дезоксирибонуклеиновой кислоты. В некоторых случаях может происходить проникновение ДНК. Благодаря процессу рекомбинации возможна интеграция этих двух разнородных элементов.
Механизм восстановления и здоровье организма
Репарация - это обязательное условие нормального функционирования организма. Подвергаясь ежедневно и ежечасно угрозам повреждений и мутаций ДНК, многоклеточная структура приспосабливается и выживает. Это происходит в том числе и за счет налаженной системы репарации. Отсутствие нормальной восстановительной способности вызывает болезни, мутации и другие отклонения. К ним относятся различные патологии развития, онкология и даже само старение. Наследственные болезни вследствие нарушений репарации могут приводить к тяжелым злокачественным опухолям и другим аномалиям организма. Сейчас определены некоторые заболевания, вызываемые именно сбоями систем репарации ДНК. Это такие, например, патологии, как ксеродерма, неполипозный рак толстой кишки, трихотиодистрофия и некоторые раковые опухоли.
Международное наименование
Хондроитина сульфат (Chondroitin sulfate)
Групповая принадлежность
Репарации тканей стимулятор
Действующее вещество
Хондроитина сульфат
Торговое наименование
Хондроитин
Лекарственная форма
мазь для наружного применения, порошок для приготовления раствора для наружного применения, линимент, гель для наружного применения
Действие препарата
Высокомолекулярный мукополисахарид, замедляющий резорбцию костной ткани и снижающий потерю Ca2+. Улучшает фосфорно-кальциевый обмен в хрящевой ткани, ускоряет процессы ее восстановления, тормозит процессы дегенерации хрящевой и соединительной ткани. Подавляет ферменты, вызывающие поражение хрящевой ткани, стимулирует синтез гликозаминогликанов, способствует регенерации суставной сумки и хрящевых поверхностей суставов, увеличивает продукцию внутрисуставной жидкости. Ввиду своей структурной близости к гепарину, препятствует образованию фибриновых тромбов в синовиальном и субхондральном микроциркуляторном русле. Уменьшает болезненность и увеличивает подвижность пораженных суставов.
Замедляет прогрессирование остеоартроза. ДМСО, входящий в состав мазевых форм, оказывает противовоспалительное, анальгезирующее и фибринолитическое действие, способствует лучшему проникновению хондроитина через клеточные мембраны.
Показания к применению
Мазь и гель: дегенеративно-дистрофические заболевания суставов и позвоночника - первичный артроз, остеоартроз с преимущественным поражением крупных суставов, межпозвонковый остеохондроз, остеопороз, пародонтопатия; переломы костей (для ускорения образования костной ткани).
Порошок для приготовления раствора для наружного применения: для ускорения репаративных процессов при длительно незаживающих ранах, трофичесике язвы, пролежни (в стадии гранулирования).
Противопоказания
Гиперчувствительность, нарушение целостности кожных покровов в местах предполагаемого нанесения.
Аллергические реакции.
Способ применения и дозы
Наружно: наносят 2-3 раза в день на кожу над очагом поражения и втирают в течение 2-3 мин до полного впитывания. Курс лечения - 2-3 нед. При необходимости курс лечения повторяют.
Порошок для приготовления раствора для наружного применения: непосредственно перед применением во флакон, содержащий 50 мг порошка для приготовления раствора для наружного применения, вводят 5 мл 0.5% раствора прокаина или 0.9% раствора натрия хлорида. Содержимое флакона тщательно взбалтывают. Образующийся вязкий раствор распределяют на поверхности двухслойной стерильной марлевой салфетки и накладываю на рану, а поверх - обычную марлевую повязку. Перевязки производят 1 раз в 2-3 дня. Продолжительность лечения в зависимости от течения - 10-30 дней.
Особые указания
Следует избегать попадания мази и геля на слизистые оболочки и открытые раны.




